Molekularbiologie und Immunologie pädiatrischer Tumorerkrankungen
Die Eigenschaften von Zellen werden insbesondere von den in diesen Zellen vorhandenen Proteinen (Eiweißstoffen) reguliert. Diese Proteine werden nach Bauplänen synthetisiert, welche im Erbgut der Zellen hinterlegt sind, wobei als Zwischenprodukt zunächst sogenannte Boten-Ribonukleinsäuren (mRNAs) gebildet werden. Die Analyse dieser mRNAs kann daher genutzt werden, um krankheitsspezifische Genexpressionsmuster zu identifizieren und auf diese Weise neue Zielstrukturen für zukünftige Therapiestrategien zu finden. Die Charakterisierung krankheitsspezifischer Genexpressionprofile stellt daher ein Hauptarbeitsgebiet unserer Arbeitsgruppe dar. Für die Analyse setzen wir moderne Verfahren ein, die es erlauben, sämtliche bekannten Gene des Menschen (und auch solche, die noch nicht bekannt sind) zu erfassen. Eines unserer Hauptinteressen liegt hierbei auf sogenannten endogener Retroviren (ERV). Für die Auswertung der oft komplexen Daten entwickeln wir teilweise neue bioinformatische Verfahren (z. B. den sogenannten GenExpressionsMusikAlgorithmus, GEMusicA).
Tumorzellen wachsen in vivo stets in enger Nachbarschaft zu normalen Zellen. Die Interaktion von Tumorzellen mit diesen sogenannten Stromazellen ist kompliziert und kann sowohl tumorfördernde, als auch tumorhemmende Komponenten betreffen. Untersuchungen zur Interaktion des Immunsystems mit Tumorzellen stellen ein wesentliches Arbeitsgebiet unserer Arbeitsgruppe dar. Die Untersuchungen werden hierbei vor allem an Ewing-Sarkomzellen, Hodgkin-Lymphomzellen und Hirntumoren durchgeführt. Unsere Untersuchungen zum Hodgkin-Lymphom werden hierbei unter anderem durch die Stiftung „Mitteldeutsche Kinderkrebsforschung“ gefördert. Die in den Untersuchungen zum Genexpressionsprofil von Tumorzellen identifizierten spezifischen Transkripte kodieren teilweise potentielle Tumorantigene, z. B. Lipase I oder PRAME), die als therapeutische Zielstrukturen interessant sindDaneben untersuchen wir insbesondere immunregulatorische Moleküle, welche von Tumorzellen oder den Zellen des Immunsystems gebildet werden und welche die gegen Tumorzellen gerichtete Immunantworten beeinflussen können.
Zusätzlich können krankheitsspezifisch exprimierte endogene Retroviren (ERV) für die Interaktion mit dem Immunsystem relevant sein.
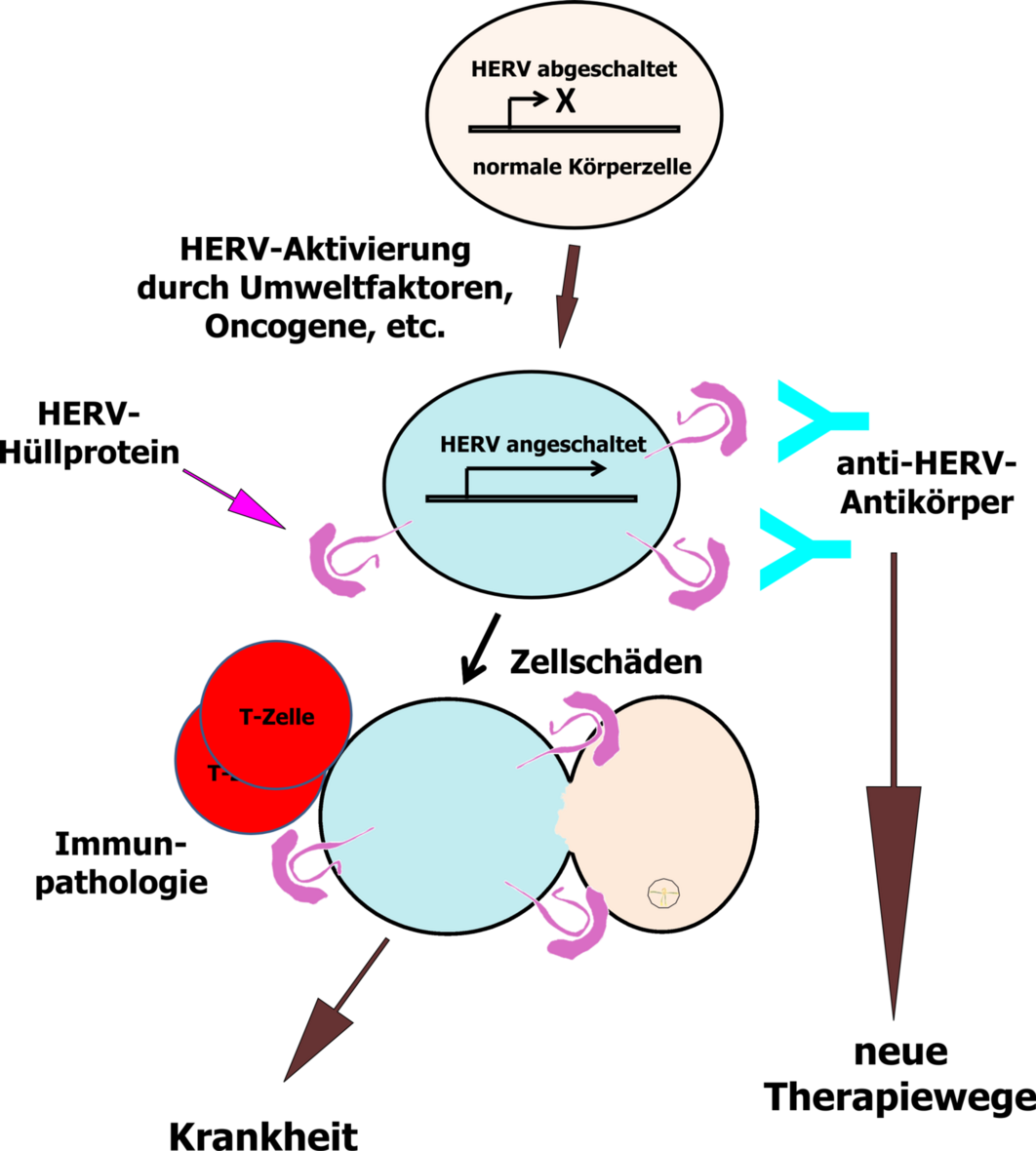
Im menschlichen Genom befinden sich überraschend viele Sequenzabschnitte, die starke Ähnlichkeit zu Retroviren haben. Ein Teil dieser Sequenzen hat so große Ähnlichkeit, dass man sie als humane endogene Retroviren (HERV) bezeichnet. Der Ursprung dieser Sequenzen wird in Viren gesehen, die im Laufe der Evolution einzelne Individuen infizierten, fest in das Erbgut eindrangen und anschließend von Generation zu Generation, wie andere Gene auch, weitergegeben wurden.
Wie bei exogenen Retroviren auch, lassen sich bei HERV einzelne Genbereiche unterscheiden, welche für verschiedene Proteine kodieren, unter anderem ein sogenanntes Hüllprotein. Durch Mutationen wurden HERV so stark verändert, dass keine infektiösen Viren mehr gebildet werden können. Es finden sich jedoch einzelne Genabschnitte, die weiterhin mehr oder weniger vollständige Proteine kodieren. Insbesondere die Hüllproteine stehen hierbei im Zentrum unserer Forschungen. Für diese Proteine werden Funktionen im Zusammenhang mit der Entstehung von Krankheiten vermutet. Daneben tragen HERV-Hüllproteine auch Funktionen im Rahmen der normalen Physiologie. So ist das Hüllprotein des sogenannten HERV-W als „Syncytin“ für den Aufbau der Plazenta unerlässlich. HERV-Proteine werden, von Ausnahmen wie dem Syncytin während der Plazentaentwicklung abgesehen, in Zellen normalerweise nicht synthetisiert. Verschiedene Kontrollmechanismen verhindern die Bildung dieser Proteine. Bei Autoimmun- und Tumorerkrankungen konnte jedoch die Bildung von HERV-Hüllproteinen nachgewiesen werden. In einigen Fällen konnten sogar Viruspartikel elektronenmikroskopisch beobachtet werden, deren Ursprung aus den in der Regel nicht mehr funktionellen HERV-Sequenzen im Genom noch nicht vollständig geklärt werden konnte. Neben genetischen Faktoren können Umweltfaktoren (wie z.B. exogene Viren) zu einer Aktivierung von HERV beitragen.
HERV-Hüllproteine können als starke Aktivatoren des Immunsystems wirken (im Sinne von sog. Superantigenen) und hierdurch insbesondere bei Autoimmunerkrankungen bei den Entzündungsvorgängen eine Rolle spielen. Daneben werden auch direkt toxische Effekte der HERV-Aktivierung auf die betroffenen Zellen angenommen. Zusätzlich können krankheitsspezifisch exprimierte endogene Retroviren (ERV) für die Interaktion mit dem Immunsystem relevant sein. Neben der Bildung von Hüllproteinen können HERV auch durch andere Faktoren pathogen wirken. Neben einzelnen HERV-Proteinen, die im Verdacht stehen selber onkogen zu wirken, können HERV-Sequenzen auch als Aktivatoren benachbarter Gene wirken und so die Expression von Onkogenen aktivieren.
Bei unseren Untersuchungen verwenden wir verschiedene Modellerkrankungen aus dem Bereich der Krebsforschung (insbesondere Hodgkin-Lymphome und Ewing-Sarkome) und Autoimmunität (insbesondere der Multiplen Sklerose).
Charakterisierung von HERV-Hüllproteinen mit dem Ziel der Entwicklung therapeutischer Antikörper für HERV-assoziierte Autoimmun- und Tumorerkrankungen
In einem durch die Europäische Union über die Investitionsbank Sachsen-Anhalt im Zeitraum vom 01. Januar 2019 bis 31. Mai 2022 geförderten und auch nach der Förderperiode fortgesetzten Projekt verfolgen wir das Ziel Antikörper zu entwickeln, welche HERV-Hüllproteine erkennen und gegebenenfalls neutralisieren können. Zusätzlich sollen die zellbiologischen und immunologischen Konsequenzen der Expression von HERV-Hüllproteinen untersucht werden. HERV-Hüllproteine, die als Kandidaten für die Entwicklung therapeutischer Antikörper dienen können, sollen durch Gen- und Proteinexpressionsanalysen identifiziert werden. Neben DNA-Mikroarray- und RNA-seq-Analysen werden hierzu massenspektrometrische Methoden eingesetzt. HERV-Hüllproteine werden sodann rekombinant hergestellt und die biologische Aktivität dieser Proteine charakterisiert. Diese Proteine dienen zugleich als Antigene für die Generierung poly- und monoklonaler Antikörper. Abschließend soll die Humanisierung geeigneter Antikörper erfolgen.
Das Projekt wird gemeinsam von den Kliniken für Pädiatrie I (apl. Prof. Dr. M. S. Staege) und Neurologie (Dr. A. Emmer) in Kooperation mit dem Fraunhofer-Institut für Zelltherapie und Immunologie (Dr. H. Cynis) in Halle (Saale) durchgeführt.
Kontakt:
AG-Leiter Prof. Dr. Martin Staege
Neuere Veröffentlichungen unserer Arbeitsgruppe:
- Rotermund A, Staege MS, Brandt S, Luetzkendorf J, Lucas H, Müller LP, Mueller T. Luciferase expressing preclinical model systems representing the different molecular subtypes of colorectal cancer. Cancers (Basel) 15:4122 (2023).
- Rotermund A, Brandt S, Staege MS, Luetzkendorf J, Mueller LP, Mueller T. Differential, CMS related expression of cell surface carbonic anhydrases IX and XII in colorectal cancer models
- Wieland L, Schwarz T, Engel K, Volkmer I, Krüger A, Tarabuko A, Junghans J, Kornhuber ME, Hoffmann F, Staege MS, Emmer A. Epstein–Barr virus-induced genes and endogenous retroviruses in immortalized B cells from patients with multiple sclerosis. Cells 11:3619 (2022).
- Ilse V, Scholz R, Wermann M, Naumann M, Staege MS, Rossner S, Cynis H. Immunogenicity of the envelope surface unit of human endogenous retrovirus K18 in mice. Int J Mol Sci 23:8330 (2022).
- Hartung C, Porsch M, Stückrath K, Kaufhold S, Staege MS, Hanf V, Lantzsch T, Uleer C, Peschel S, John J, Pöhler M, Weigert E, Buchmann J, Bürrig KF, Schüler K, Bethmann D, Große I, Kantelhardt EJ, Thomssen C, Vetter M. Identifying high-risk TNBC patients by molecular subtyping of a prospective cohort. Breast Care 16:637-647. (2021).
- Wieland L, Engel K, Volkmer I, Krüger A, Posern G, Kornhuber ME, Staege MS, Emmer A. Overexpression of endogenous retroviruses and malignancy markers in neuroblastoma cell lines by medium-induced microenvironmental changes. Front Oncol 11:637522 (2021).
- Engel K, Wieland L, Krüger A, Volkmer I, Cynis H, Emmer A, Staege MS. Identification of differentially expressed human endogenous retrovirus (HERV) families in human leukemia and lymphoma cell lines and in stem cells. Front Oncol 11:637981 (2021).
- Brütting C, Stangl G, Staege MS. Association of vitamin D and endogenous retroviruses in multiple sclerosis. J Integr Neurosci 20:233-238 (2021).
- Staege MS. Using gene expression music algorithms (GEMusicA) for the characterization of human stem cells. In: In vitro models for stem cell therapy: methods and protocols (Stock P, Christ B, Eds.). Methods Mol Biol 2229:205-219. Totowa, Humana Press (2021).
- Baier J, Gwellem AC, Haase R, Volkmer B, Bartling B, Staege MS. Co-culture of peripheral blood mononuclear cells and endothelial colony forming cells from cord blood of preterm born babies. In: In vitro models for stem cell therapy: methods and protocols (Stock P, Christ B, Eds.). Methods Mol Biol 2229:107-124. Totowa, Humana Press (2021).
- Gröger V, Emmer A, Staege MS, Cynis H. Endogenous retroviruses in nervous system disorders. Pharmaceuticals 14:70 (2021). Emmer A, Kornhuber ME, Staege MS. Krebserkrankungen: Humane endogene Retroviren. Dtsch Arztebl 118: A-1066-1067 (2021).
- Staege MS. Osimertinib in EGFR-Mutated Advanced NSCLC. N Engl J Med 7;382:1863-1864 (2020).
- Kreinest T, Volkmer I, Staege MS. Melittin increases cisplatin sensitivity and kills KM-H2 and L-428 Hodgkin lymphoma cells. Int J Mol Sci 22:343 (2020).
- Gröger V, Wieland L, Naumann M, Meinecke AC, Meinhardt B, Rossner S, Ihling C, Emmer A, Staege MS, Cynis H. Formation of HERV-K and HERV-H/F envelope family members is suppressed on transcriptional and translational level. Int J Mol Sci 21:7855 (2020).
- Schneider J, Volkmer I, Engel K, Emmer A, Staege MS. Expression of a new endogenous retrovirus-associated transcript in Hodgkin lymphoma cells. Int J Mol Sci 20:5320 (2019).
- Staege MS. Are EWSR1-FLI positive cell lines from patients with other diagnoses than Ewing sarcoma really Ewing sarcoma cell lines? Pediatr Blood Cancer 22:e27769 (2019).
- Staege MS, Emmer A (eds.). Endogenous viral elements – links between autoimmunity and cancer? 150pp. Lausanne, Frontiers Media (2019).
- Brown P, RELISH Consortium, Zhou Y. Large expert-curated database for benchmarking document similarity detection in biomedical literature search. Database (Oxford) 2019:baz085 (2019).
- Emmer A, Abobarin-Adeagbo A, Posa A, Jordan B, Delank KS, Staege MS, Surov A, Zierz S, Kornhuber ME. Myositis in Lewis rats induced by the superantigen Staphylococcal enterotoxin A. Mol Biol Rep 46:4085-4094 (2019).
- Kewitz-Hempel S, Kurch L, Cepelova M, Volkmer I, Sauerbrey A, Conrad E, Knirsch S, Pöpperl G, Steinbach D, Beer AJ, Kramm CM, Sahlmann CO, Erdlenbruch B, Reinbold WD, Odparlik A, Sabri O, Kluge R, Staege MS. Impact of rs12917 MGMT polymorphism on early 18F-FDG-PET response in pediatric Hodgkin lymphoma (PHL). Mol Imaging Biol 21:1182-1191 (2019).
- Barth M, Gröger V, Cynis H, Staege MS. Identification of human endogenous retrovirus transcripts in Hodgkin lymphoma cells. Mol Biol Rep 46:1885-1893 (2019).
- Emmer A, Wieland L, Kornhuber M, Zierz S, Klusmann JH, Gröger V, Cynis H, Staege MS. Grundlagenforschung: Endogene Retroviren. Leben 19:II,22-23 (2019).
- Emmer A, Posa A, Staege MS, Kornhuber M. Hüllproteine humaner endogener Retroviren (HERV) und andere Superantigene: Pathogenetisches Modell für Entzündungsvorgänge bei Multipler Sklerose. neuro aktuell 32:15-17 (2018).
- Staege MS, Emmer A. Humane endogene Retroviren, Epstein-Barr-Viren und Multiple Sklerose. neuro aktuell 32:16-20 (2018).
- Kruse K, Nettling M, Wappler N, Emmer A, Kornhuber M, Staege MS, Grosse I. WebHERV: A web-server for the computational investigation of gene expression associated with endogenous retrovirus-like sequences. Front Microbiol 9:2384 (2018).
- Mueller T, Hantsch C, Volkmer I, Staege MS. Differentiation-dependent regulation of human endogenous retrovirus K sequences and neighbouring genes in germ cell tumour cells. Front Microbiol 9:1253 (2018).
- Emmer A, Brütting C, Kornhuber M, Staege MS. Genetic determinants of antibody levels in cerebrospinal fluid in multiple sclerosis: possible links to endogenous retroviruses. Int J Mol Sci 19:E786 (2018).
- Staege MS, Emmer A. Editorial: Endogenous viral elements - links between autoimmunity and cancer? Front Microbiol 9:3171 (2018).
- Brütting C, Narasimhan H, Hoffmann F, Kornhuber ME, Staege MS, Emmer A. Investigation of endogenous retrovirus sequences in the neighborhood of genes up-regulated in a neuroblastoma model after treatment with hypoxia-mimetic cobalt chloride. Front Microbiol 9:287 (2018).
- Giebler M, Staege MS, Blauschmidt S, Ohm LI, Kraus M, Würl P, Taubert H, Greither T. Elevated HERV-K expression in soft tissue sarcoma is associated with worsened relapse-free survival. Front Microbiol 9:211 (2018).
- Schutkowski A, Max D, Bönn M, Brandsch C, Grundmann SM, Hirche F, Staege MS, Stangl GI. Impact of vitamin D on adipose tissue size in young and old mice. Mol Nutr Food Res 62:1700726 (2018).
- Posa A, Kornhuber MA, Staege MS, Emmer A. Multiple Sklerose: Pathogenetischer Paradigmenwechsel – Humane endogene Retroviren als Auslöser der Erkrankung? Versicherungsmedizin 70:134-139 (2018).
- Blüher S, Richer M, Staege MS. Body weight regulation, socioeconomic status and epigenetic alterations. Metabolism 85:109-115 (2018).
- Bustamante Rivera YY, Brütting C, Schmidt C, Volkmer I, Staege MS. Endogenous retrovirus 3 - history, physiology, and pathology. Front Microbiol 8:2691 (2018).
- Brütting C, Emmer A, Kornhuber ME, Staege MS. Co-occurrences of putative endogenous retrovirus-associated diseases. Biomed Res Int 2017:7973165 (2017).
- Kühnöl CD, Würfel C, Staege MS, Kramm CM. Snail homolog 1 (SNAI1) is involved in epithelial-mesenchymal transition-like processes in human glioblastoma cells. Oncol Letters 13:3882-3888 (2017).
- Emmer A, Staege MS. Degeneration und Entzündung bei multipler Sklerose - Die Rolle humaner endogener Retroviren. Current Congress 20 (2017).
- Gerlach K, Tomuschat C, Finke R, Staege MS, Brütting, C, Brandt J, Jordan B, Rosemeier A, Schwesig R, Delank KS, Kornhuber ME, Emmer A. Experimental arthritis in the rat induced by the superantigen staphylococcal enterotoxin A (SEA). Scand J Immunol 85:191-196 (2017).
- Stock P, Bielohuby M, Staege MS, Hsu MJ, Bidlingmaier M, Christ B. Impairment of host liver repopulation by transplanted hepatocytes in aged rats and the release by short-term growth hormone treatment. Am J Pathol 187:553-569 (2017).
- Braune K, Volkmer I, Staege MS. Characterization of Alstrom syndrome 1 (ALMS1) transcript variants in Hodgkin lymphoma cells. PLoS One 12:e0170694 (2017).